EZH2/EZH1抑制剂Valemetostat治疗R/R NHL的首个人体临床研究
Abstract #014
First-in-human study of the EZH1 and EZH2 Dual Inhibitor Valemetostat Tosylate (DS-3201b) in Patients with Relapsed or Refractory non-Hodgkin lymphoma
EZH2的表达变化与非霍奇金淋巴瘤(NHL)的发生密切相关。Valemetostat是一种新型、强效、选择性EZH2/EZH1抑制剂。当前这篇摘要展示了Valemetostat治疗R/R NHL(包括PTCL和ATL)患者Ⅰ期临床试验的中期分析结果。
入组R/R NHL患者接受Valemetostat(每日一次口服;剂量递增150‐300 mg/day、剂量扩展200 mg/day)治疗,持续28天为一个周期,直至疾病进展或患者不能耐受。研究主要目标为评估药物的安全性并确定Ⅱ期研究的推荐剂量。次要目标包括初步评估药物的疗效。
截至2020年11月2日,78例R/R NHL患者接受了治疗,其中62例患者使用的药物剂量为200 mg。中位随访28.1周(范围:3.1‐190.9)。患者中位年龄为68岁(范围:37‐88)。
绝大多数NHL(97.4%)出现≥1级治疗相关不良事件(TEAE)。51例患者(65.4%)出现≥3级TEAEs;16例患者(20.5%)出现严重的≥3级TEAEs;未观察到与Valemetostat相关的死亡出现。有32例(41%)和7例(9%)患者因TEAE而分别导致治疗中断或药物剂量减少。最常见的AEs(≥30%的患者)为血小板计数减少(59.0%)、味觉障碍(51.3%)、贫血(37.2%)、中性粒细胞计数减少(34.6%)、脱发(32.1%)和白细胞计数减少(30.8%)。分别有12例(15.4%)和4例(5.1%)患者出现≥3级血小板计数减少和血小板减少症。PTCL以及ATL患者的安全性结果与总体人群相似。
45例R/R PTCL患者的初步疗效分析显示,患者总体缓解率为55.6%(95% CI, 40.0%‐70.4%),其中11例患者完全缓解,14例患者为部分缓解。中位缓解持续时间(mDOR)为56.0周(95% CI, 44.43‐NE),中位治疗首次起效时间(mTTR)为8.14周(范围:4.1‐24.1),中位无进展生存(mPFS)为52周(95% CI, 16.14‐NE)。初步疗效分析显示,R/R ATL患者ORR为50.0%(95% CI, 23.0%‐77.0%; 包含3例CR和4例PR),mDOR尚不可评估(范围:6.14周‐NE);mTTR为8.14周(范围:7.3‐84.1),mPFS尚不可评估(95% CI, 8.14‐NE)。不同PTCL亚型患者均可观察到疗效:AITL、PTCL-NOS、ALCL及其他类型T细胞淋巴瘤患者ORR分别为70.6%、47.6%、50.0%和40.0%。
结论:Valemetostat在R/R NHL中显示出可接受的安全性,初步疗效分析显示Valemetostat对于R/R PTCL及ATL患者具有较好的疗效。研究人员将在日本开展针对R/R ATL的Ⅱ期研究,此外还将开展一项Valemetostat治疗R/R PTCL(含R/R ATL)患者的Ⅱ期全球研究。
2020年,全球首个EZH2抑制剂Tazemetostat获FDA批准上市,它在淋巴瘤治疗方面的疗效良好。Tazemetostat单药在r/rFL(MTEZH2)上ORR高达69%,单药活性高于BTK抑制剂、PI3K抑制剂和BCL2抑制剂。此外,在复发难治性弥散性大B细胞淋巴瘤(DLBCL)伴有EZH2突变者,Tazemetostat也表现出了单药不错的疗效。
本研究介绍的新型、强效、选择性EZH2/EZH1双靶点抑制剂——Valemetostat的I期临床试验。纳入R/R NHL患者的年龄较高,最大年龄达到88岁。在安全性方面,治疗相关的不良反应较重,65.4%的患者出现≥3级TEAEs,但是没有治疗相关死亡病例。
值得关注的是,Valemetostat单药治疗45例复发难治外周T(R/R PTCL)的疗效显著,总体缓解率为55.6%,CR率达到25%,中位缓解持续时间达到1年左右(56.0周),而且起效快(中位:8周)。另外,对于目前治疗比较棘手、缺乏有效治疗药物的成人ATL患者,仍具有不错的疗效,有效率可达到50%。因此,Valemetostat值得进一步的深入研究。
Glofitamab递增剂量给药为多线治疗R/R NHL患者带来高完全缓解率
Abstract #015
Glofitamab Step-up dosing: Updated Efficacy Data Show High Complete Response Rates in Heavily Pretreated Relapsed/Refractory (R/R) Non-Hodgkin lymphoma (NHL) patients
Glofitamab(RG6026)是一款靶向CD20和CD3的双特异性抗体,具有2个CD20结合位点和1个CD3结合位点。NP30179研究(NCT0307569)是一项正在进行的多中心、Ⅰ期剂量递增与剂量扩展研究。研究显示,Glofitamab(0.6-25 mg)联合Obinutuzumab预处理能为先前经过多线治疗的R/R NHL患者带来更高、更持久的完全缓解,且安全性可控。在Obinutuzumab+递增剂量(SUD)Glofitamab治疗方案中,Glofitamab剂量可增至30mg以最大程度地发挥药效,并同时降低CRS发生风险。当前这篇摘要显示了Glofitamab单药治疗SUD队列的疗效更新数据。
在Glofitamab初次给药7天前给予患者1000 mg剂量的Obinutuzumab。静脉输注Glofitamab(SUD),输注时间为每个周期的D1和D8,自第2个周期D1开始应用目标剂量(2.5/10/16mg或2.5/10/30mg),治疗持续12个周期,每个周期21天。基于Lugano标准评估治疗缓解率。
52例患者接受Glofitamab(SUD)治疗;分别有17例患者和35例患者接受2.5/10/16mg和2.5/10/30mg剂量用药。28例患者(53.8%)为侵袭性NHL;24例患者为惰性NHL。患者中位年龄为68岁((44–85),先前接受过中位3线(1–12)系统性治疗。有40例(76.9%)和38例(73.1%)患者分别对最近一次抗CD20治疗或先前任何一次抗CD20治疗耐药。
中位随访6.3个月后于2020年12月1日进行疗效数据更新分析。研究中侵袭性NHL患者(N = 28)最佳总体缓解(OR)率和完全代谢缓解(CMR)率分别为64.3%和57.1%。目标剂量增加能观察到患者疗效改善的趋势,2.5/10/30mg剂量组患者(N = 14)CMR率达71.4%。值得注意的是,4/5例套细胞淋巴瘤患者(80%)出现CMR(2.5/10/16mg, n = 2; 2.5/10/30mg, n = 2)。侵袭性NHL患者中,13/16例患者正处于CMR,其中8例CMR患者持续时间已超过3个月。对于惰性NHL患者(N = 24),OR和CMR率分别为79.2%和70.8%。14/17例患者正处于CMR,其中10例CMR患者持续时间已超过3个月。
截至2020年8月3日,常见的不良事件(52例)为CRS(63.5%)、中性粒细胞减少(38.5%)和发热(32.7%)。CRS主要发生在第1个治疗周期中:24/50例患者在2.5 mg剂量应用Glofitamab后出现CRS;20/49例患者在10 mg剂量应用Glofitamab后出现CRS。分别有2/16例和8/32例患者在16和30 mg剂量应用Glofitamab后出现CRS(C2D1)。分别有18例(34.6%)和12例(23%)例患者出现1级和2级CRS;3例患者出现3级CRS;未观察到4/5级事件的发生。此外,研究人员还将报告基线肿瘤CD20表达、CD8水平等生物标志物分析的更新数据。
疗效更新数据显示,多线治疗失败的R/R NHL患者接受Glofitamab单药治疗SUD方案的缓解率要高于先前所报告的初步分析数据。绝大多数CRS级别较低且可控,且多发生于第1个疗程。
在免疫治疗中,双抗可谓是后起之秀。特别是近两年,都是领域的研究热点。临床医生对于免疫治疗的评价主要关注:安全、有效、简便、性价比高。个人认为Glofitamab双抗是目前比较符合以上我们期待的一种免疫治疗药物。它是一款特殊2:1靶向CD20和CD3的双特异性抗体。期待提高疗效同时,可降低CRS的发生率。该研究中位随访6.3个月,OR率和CMR率分别为64.3%和57.1%,而且维持时间长。惰性淋巴瘤OR和CMR率可高达79.2%和70.8%。对于R/R NHL患者而言,疗效令人鼓舞。
虽然该药CRS发生率63.5%,但是症状较轻,维持时间短。目前,关于Glofitamab的临床研究正在如火如荼地开展,相信它必将给淋巴瘤免疫治疗带来新的选择和希望。
Epcoritamab皮下给药治疗R/R B-NHL的安全性和疗效
Abstract #016
Subcutaneous Epcoritamab in Patients With Relapsed/Refractory B-Cell Non-Hodgkin Lymphoma: Safety Profile and Anti-tumor Activity
Epcoritamab是一款靶向CD20和CD3的双特异性抗体。当前这篇摘要展示了Epcoritamab治疗R/R B-NHL的Ⅰ/Ⅱ期首个人体临床试验的更新数据(包括剂量递增部分研究的患者PFS)。
入组的R/R CD20+ B-NHL成人患者接受1 mL剂量的Epcoritamab(皮下注射,递增剂量给药),28天为1个周期(周期1-2:q1w;周期3-6:q2w;之后:q4w)直至疾病进展或出现不可耐受毒性。通过递增剂量给药和标准预防措施来减轻CRS的严重程度。
截至2021年1月31日,共有68例B-NHL患者(包括46例DLBCL、12例FL、4例MCL、及6例其他B-NHL)被纳入本项研究。绝大多数患者先前接受了多线治疗(先前中位线数:DLBCL为3[1-6];FL为4.5[1-18]),其中包括既往CAR-T细胞治疗(n = 6)和既往ASCT(n = 10)。患者中位随访时间为14.1个月(DLBCL患者为10.2个月;FL患者为15.2个月),15例(22%)患者正在进行治疗。最常见的治疗期间出现的不良事件为发热(69%)、CRS(59%)和注射部位反应(47%)。CRS事件均为1级或2级,且大多数发生在治疗的第1个周期;研究观察到有限的神经毒性事件(6%;均为暂时性)。研究中观察到1例肿瘤溶解综合征(1.5%;3级),未观察到发热性中性粒细胞减少症或治疗相关死亡病例。
疗效方面,在DLBCL患者中,剂量≥12 mg组(n = 22)与剂量≥48 mg组(n = 11)总体缓解率分别为68%(CR = 46%;PR = 23%)和91%(CR = 55%;PR = 36%)。FL患者中,剂量≥12 mg组(n = 5)总体缓解率为80%(CR = 60%;PR = 20%);MCL患者中,剂量≥0.76 mg组(n = 4)总体缓解率为50%(CR = 25%;PR = 25%)。随着治疗时间延长,患者缓解程度加深(6例DLBCL及3例FL患者由PR转化为CR)。DLBCL的中位至缓解时间为1.4个月;中位至CR时间为2.7个月。FL中位至缓解时间为1.9个月。剂量≥6 mg组(n = 11)达到CR的所有DLBCL患者均未在治疗中复发。剂量≥12 mg组(n = 22)DLBCL患者的中位PFS为9.1个月(95% CI:1.6-NE;中位随访9.3个月);而剂量≥48 mg组(n = 11)DLBCL患者的中位PFS尚未可得(中位随访8.8个月)。
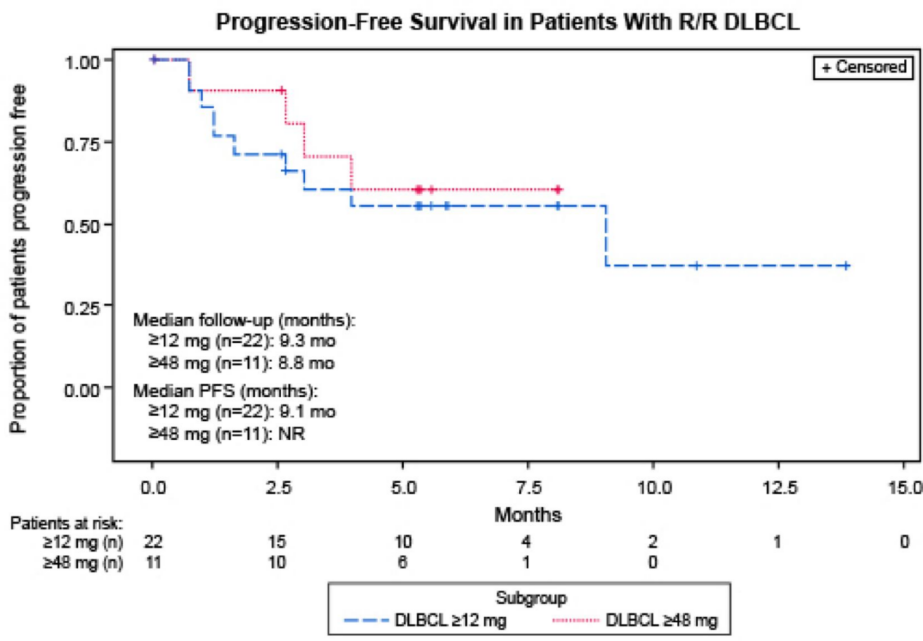
随着随访时间的延长,Epcoritamab皮下给药显示出良好的单药活性,不仅能为患者带来深度且持久的临床缓解,且安全性数据与既往一致。值得注意的是,未观察到患者出现严重(≥3级)CRS事件、发热性中性粒细胞减少症,且患者神经毒性事件发生率低。
双抗具有不同的形式。Epcoritamab,是一款皮下注射的靶向CD20和CD3的全新双特异性抗体。此项研究的亮点在于皮下注射,它让免疫治疗更加简便。
安全性方面,CRS发生率与静脉注射的相似(59%),均为1级或2级,且大多数发生在治疗的第1个周期。疗效方面,在DLBCL患者中,低剂量组OR为68%、CR为46%,高剂量组的OR高达91%、CR达到55%。惰性淋巴瘤患者中,采用低剂量治疗FL的OR为80%、CR为60%。MCL患者中,OR为50%、CR为25%。并且,研究结果提示随着治疗时间延长,患者缓解程度加深。
皮下注射双抗的疗效不亚于静脉注射的效果。Epcoritamab进一步临床试验结果非常值得我们期待。





 京公网安备 11010502033352号
京公网安备 11010502033352号