编者按?:近年来,肽受体放射性核素治疗(PRRT)为众多晚期神经内分泌肿瘤(NET)药物治疗无反应患者带来了延续生命的希望,并有向一线治疗挑战的趋势。在2021年ASCO大会上,NETTER-1研究披露了随访9年OS结果,NETTER-R研究总结了真实世界数据。两项研究为PRRT从临床试验到真实世界的疗效和安全交出了一份精彩的“答卷”。北京大学肿瘤医院于江媛教授对两项研究介绍和点评如下。
4112——NETTER-1研究
大名鼎鼎的NETTER-1研究是一项III期国际多中心随机对照研究,入组的是不可手术的前期长效奥曲肽30mg治疗进展的中肠NET患者,治疗组为177Lu-DOTATAE+长效奥曲肽30mg,对照组为长效奥曲肽加量至60mg。该研究结果首次发布便荣登《新英格兰医学杂志》(N Engl J Med),以PFS(无进展生存期)为主要研究终点,28.4个月对比对照组8.5个月的优秀成绩惊艳NET治疗领域,直接推动了PRRT在European Commission 以及 FDA的正式获批,也奠定了PRRT作为GEP-NET诸治疗方案中的翘楚地位。
从2012年9月入组第一个病例至今,九年过去了,时间足以给出答案。NETTER-1研究中位随访时间近77个月,其次要研究终点OS(总生存时间)于2021 ASCO公布,虽然只是一个POSTER(摘要号:4112),但饱含了NET专家们“择一事终一生”的恒心与努力,其结果同样熠熠生辉,值得思考。
NETTER-1研究的治疗组和对照组后续进行随访或至少一种以上的系统性治疗,包括化疗、依维莫司、再次177Lu-DOTATAE PRRT或其他放射性配体介导的PRRT。最终,177Lu-DOTATAE组以11.7个月的OS优势胜于长效奥曲肽60mg对照组(48.0个月 vs 36.3个月),然而这样的成绩却并没有达到统计学意义(HR: 0.84,95%CI:0.6~1.17,P=0.30)。临床获益明显,但统计学上不显著,Statistics真是一门很玄妙的科学……
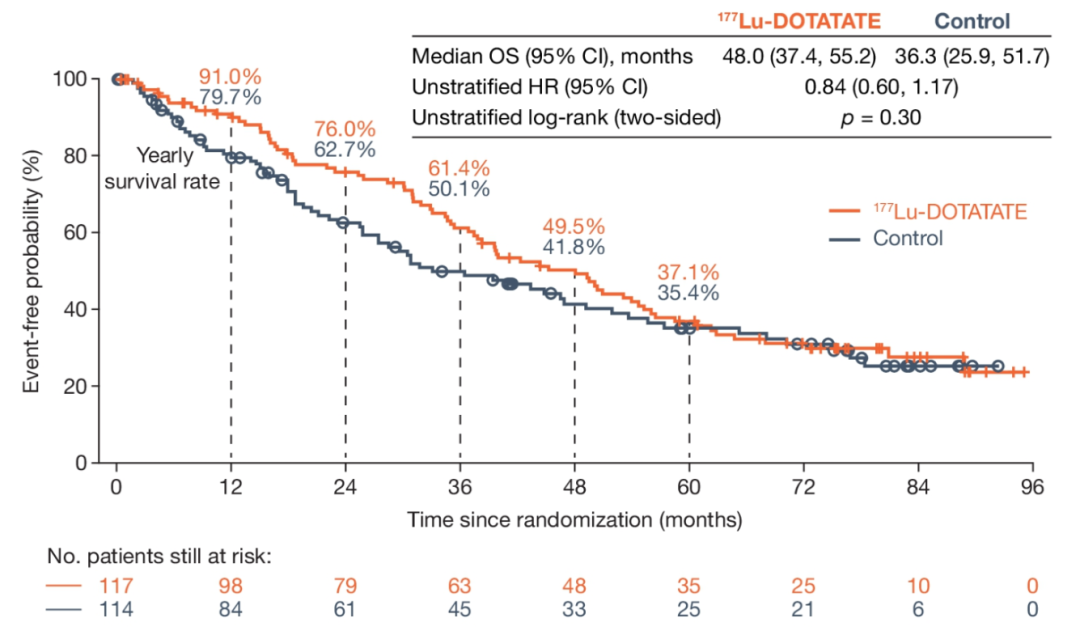
图1. ITT人群的OS生存曲线
分析原因,有以下几点供读者参考:① 长效奥曲肽60mg对照组后续有36%的患者,交叉到了PRRT治疗组,其中31.6%的患者选择了177LuDOTATAE治疗。由此也折射出核素治疗在中肠NET治疗选择中的霸主地位;② 治疗组后续有12%的患者选择了PRRT再治疗,对于前期PRRT治疗获益(CR+PR+SD)的NET人群,再进展时PRRT仍不失为可选择的有效治疗手段之一;③ 177Lu-DOTATAE治疗组有约一半以上的患者后续没有进行任何治疗。考虑第一条因素的影响,NETTER-1的研究者们将对照组的OS修正到30.9个月。由此,对照组与治疗组的OS差距进一步加大到17.1个月。

图2. 调整交叉治疗后的OS生存曲线
Statistics冰冷的数字无法诠释NET患者OS随访的艰辛以及多因素对生存的影响。因此,在诸多的NET领域临床研究中,PFS仍旧是主要研究终点。NETTER-1研究给了我们很多启示,不仅仅是PRRT不俗的成绩,更有对照组长效奥曲肽加量的8.5个月PFS获益,长期随访OS的差异,也为PRRT治疗顺序前移提供了有力依据。未来的NETTER-2研究,正是进一步扩大了PRRT的适应证以及将PRRT作为一线治疗选择,对照组仍旧是老朋友长效奥曲肽60mg。值得鼓舞的是,NETTER-2研究也将纳入中国患者的数据,PRRT的高级别临床研究将在中华大地打响,未来可期!
NETTER-R研究(摘要号:4116)回顾性分析了来自英国、法国和西班牙的多中心胰腺NET(pNET)PRRT治疗数据。这是一项来自真实世界的研究,入组了110例转移性的前期治疗进展的pNETs(至少一线及以上的化疗、靶向治疗、SSA治疗及其他抗肿瘤治疗),治疗药物为177Lu-DOTATAE。研究结果也很惊艳!主要研究终点PFS为24.8个月,次要研究终点OS为41.4个月,ORR高达40.3%,PR率足以和CAPTEM方案的最佳疗效媲美!安全性方面,III度的贫血、淋巴细胞减少及血小板减少发生率分别为0.9%、5.4%和0.9%,肾功能损伤的发生率为5.4%,15.5%的患者因不良反应调整了PRRT治疗方案,无人中断治疗。
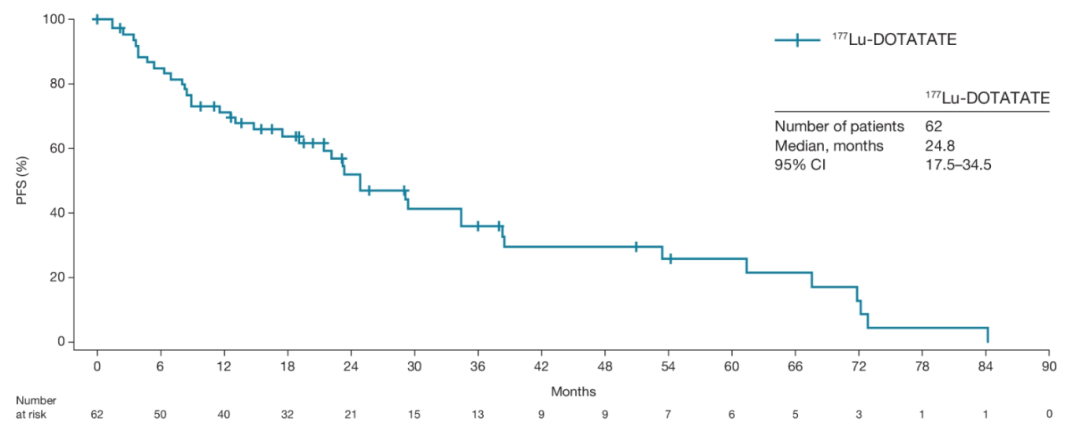
图3. PFS生存曲线
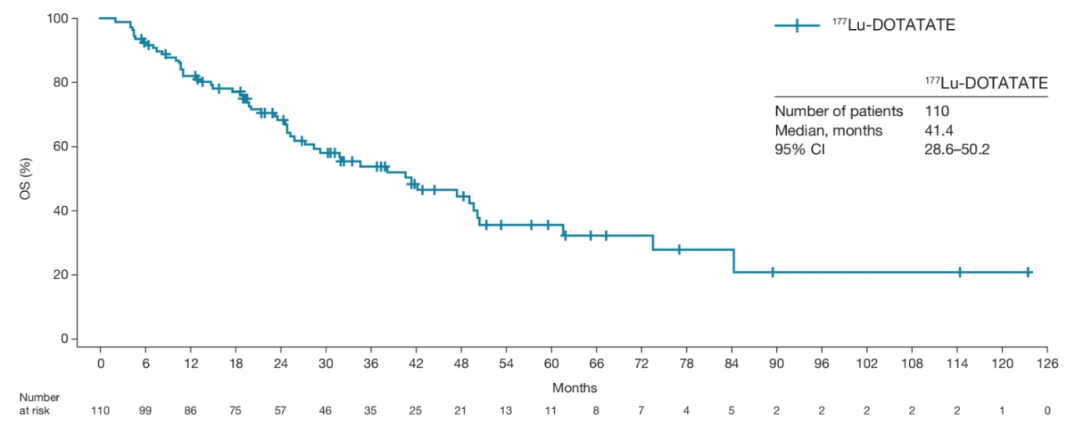
图4. OS生存曲线
表1. 肿瘤最佳治疗反应
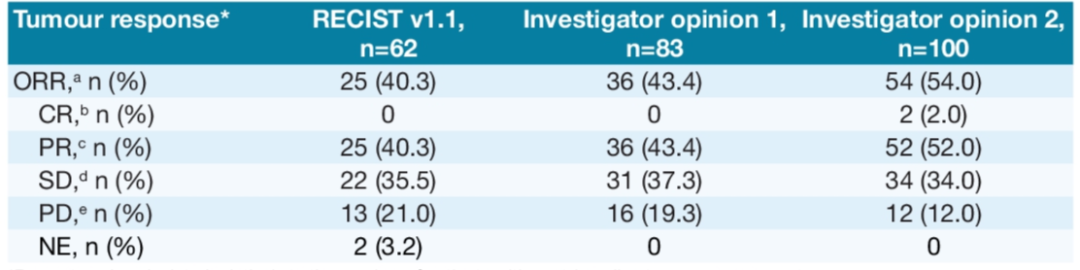
表2. 治疗相关不良事件
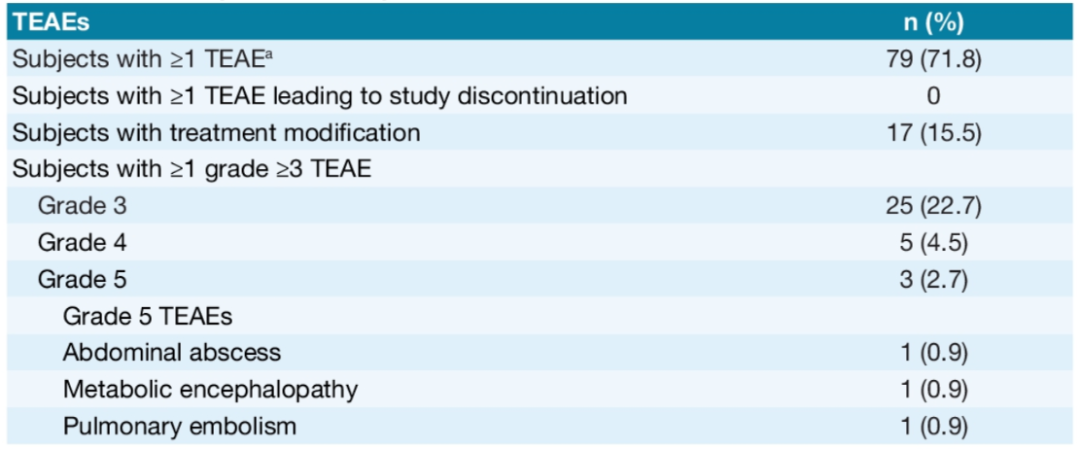
NETTER-R研究虽证据等级上稍逊于NETTER-1这样的多中心随机对照研究,但作为来自于真实世界的多中心回顾性研究,其结果依旧有很多启示意义:① 该研究奠定了PRRT在pNET中的治疗价值,高ORR长PFS的优秀成绩毫无悬念的PK掉很多对手,况且这样的成绩是在二线甚至多线治疗的位置中取得的;② 安全性数据证明PRRT在pNET治疗中耐受良好;③ 与NETTER-1研究相比,ORR令人满意(40.3% vs 18%),其原因一是因为pNET可能比中肠NET对核素治疗更加敏感;其次我个人认为更加重要的,是真实世界中,PRRT治疗的选择会经过优选甚至是多学科讨论,核医学医生会根据NET患者的体重、病灶负荷、受体表达、肿瘤进展速度等诸多因素,制定个体化治疗剂量和间隔,而多中心随机对照研究中,只能按照研究方案固定剂量和间隔。
NETTER-R结果在今年ASCO的绽放,无疑将会是确立PRRT pNET治疗江湖地位的浓墨重彩的一笔,期待未来全文的出现,也期待更详细的分层数据公布!
注:PRRT治疗NET尚未在中国获批
Net2106585
副主任医师
北京大学肿瘤医院核医学科
2017年于Johns Hopkins Hospital 访学一年,2019年于Zentraclinik Bad Berka交流学习PRRT,主要研究方向为神经内分泌肿瘤核素靶向诊治一体化等。
社会任职:
CSCO神经内分泌肿瘤专家委员会委员
CSCO核医学专委会委员
中国抗癌协会胰腺癌专业委员会神经内分泌肿瘤学组委员
中国医疗保健国际交流促进会神经内分泌肿瘤分会委员
中国女医师协会临床肿瘤学专业委员会委员





 京公网安备 11010502033352号
京公网安备 11010502033352号