经IHC检测的ER+乳腺癌中,推荐辅助内分泌治疗的ER阳性表达适当的阈值是:
选择“≥1%”和选择“≥10%”的专家各占一半。

Luminal A型淋巴结阴性乳腺癌:辅助内分泌治疗的阈值为?
超过一半专家(58.82%)认为“微浸润”的肿瘤即需要辅助内分泌治疗,超过五分之一的专家(21.57%)的专家认为“1mm”以上的肿瘤才需要辅助内分泌治疗,另有9.8%选择“5mm”、3.92%选择“6mm”、1.96%选择“8mm”、3.92%的专家选择“10mm”作为辅助内分泌治疗的阈值。

Luminal B型淋巴结阴性乳腺癌:辅助内分泌治疗的阈值为?
同样,超过一半专家(58.49%)认为“微浸润”的肿瘤即需要辅助内分泌治疗,超过五分之一的专家(20.57%)的专家认为“1mm”以上的肿瘤才需要辅助内分泌治疗,另有7.55%选择“5mm”、7.55%选择“2mm”,5.66%的专家选择“6mm”,1.89%的专家选择“10mm”
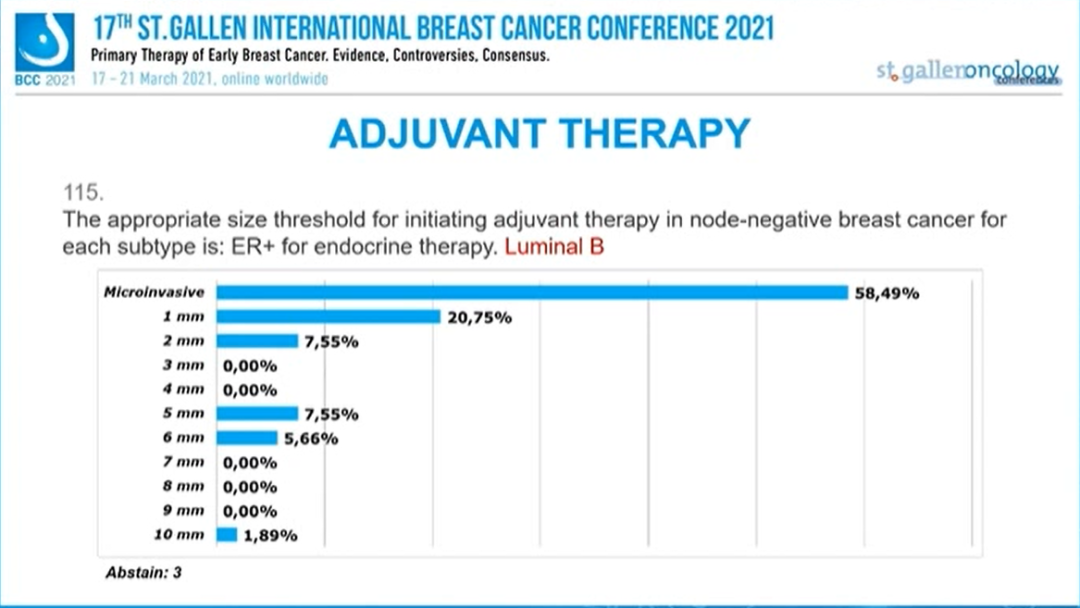
ER+/HER2+淋巴结阴性乳腺癌:抗HER2辅助治疗的阈值是?
半数专家(50.94%)认为“5mm”以上、22.64%的专家认为是“6mm”以上的肿瘤才需要抗HER2治疗,15.09%的专家认为“微浸润”肿瘤即需要抗HER2治疗。此外,3.77%选择“1mm”、1.89%选择“2mm”、3.77%选择“3mm”、1.89%的专家选择“4mm”,1.89%的专家选择“10mm”。
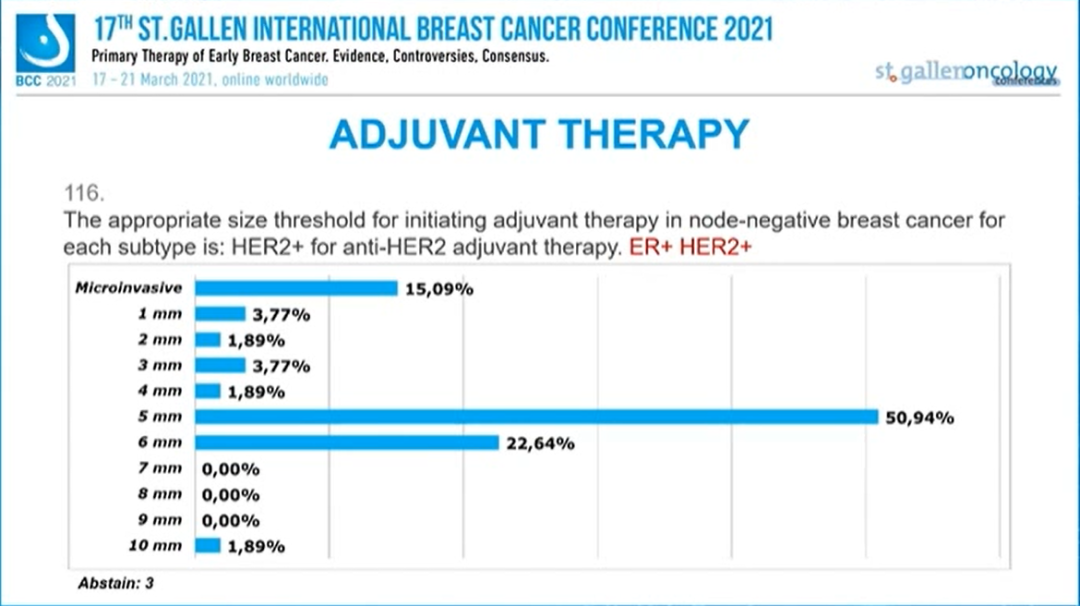
ER-/HER2+淋巴结阴性乳腺癌:抗HER2辅助治疗的阈值是?
选择“5mm”的专家最多,为32.69%,其次为“6mm”(19.23%)、“微浸润”(11.54%)、“1mm”(11.54%)、“2mm”(7.69%),少数专家选择“4mm”(3.85%)、“10mm”(1.92%)。

TNBC且淋巴结阴性乳腺癌:辅助治疗合适的阈值是:
同样,选择“5mm”的专家最多,为45.65%;其次为“6mm”(19.57%),其他相似,8.70%选择“微浸润”,6.52%选择“1mm”,4.35%选择“2mm”,6.52%选择“3mm”,8.70%选择“4mm”,6.52%的专家选择“10mm”,8人弃权。

对于接受了5年OFS+TAM治疗的绝经前高危患者,你是否会延长治疗?
4.08%的专家选择“是,并且会继续给予5年OFS+TAM治疗”,44.90%的专家选择“是,但且只选择5年TAM延长治疗”,40.82%的专家选择“是,会继续给予5年AI治疗(如果仍然处于绝经前则+OFS)”

对于ER+/HER2-淋巴结阳性的乳腺癌,内分泌治疗的最佳疗程是?
11.32%的专家选择“5年”,33.96%的专家选择“7~8年”,52.83%的专家选择“10年”,1.89%的专家选择“不确定”。

≥4个阳性淋巴结的ER+患者是否应该接受CDK4/6抑制剂阿贝西利辅助治疗?
54%的专家选择“是”,46%的专家选择“否”,7人弃权。
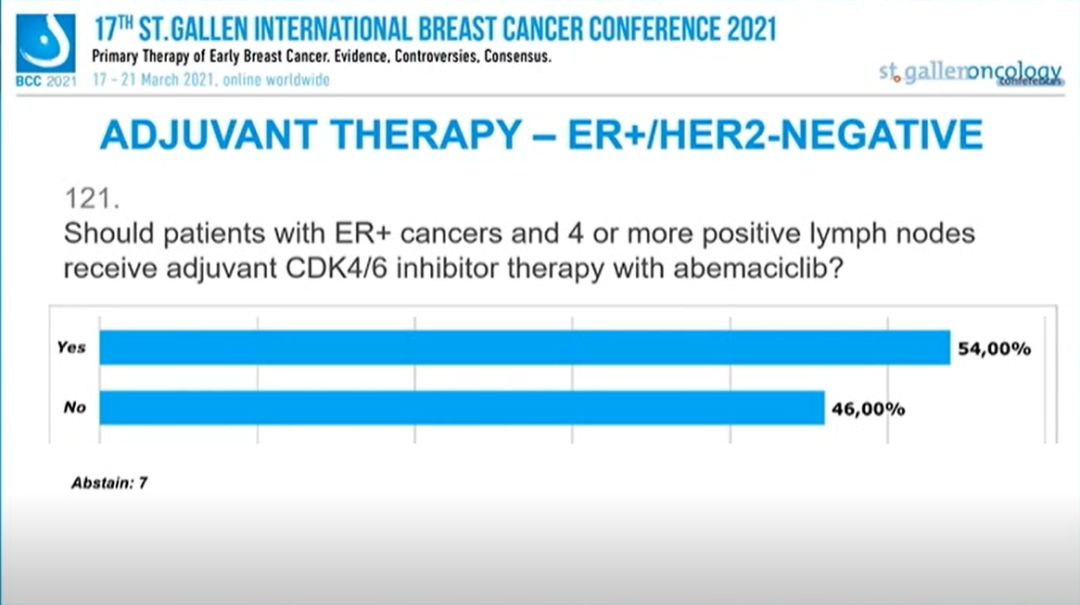
1~3个淋巴结阳性,G3或/和T3,或高Ki67的ER+患者是否应该接受CDK4/6抑制剂阿贝西利辅助治疗(即MONARCH-E入组条件)?
46.3%的专家选择“是”,53.7%的专家选择“否”,3人弃权。
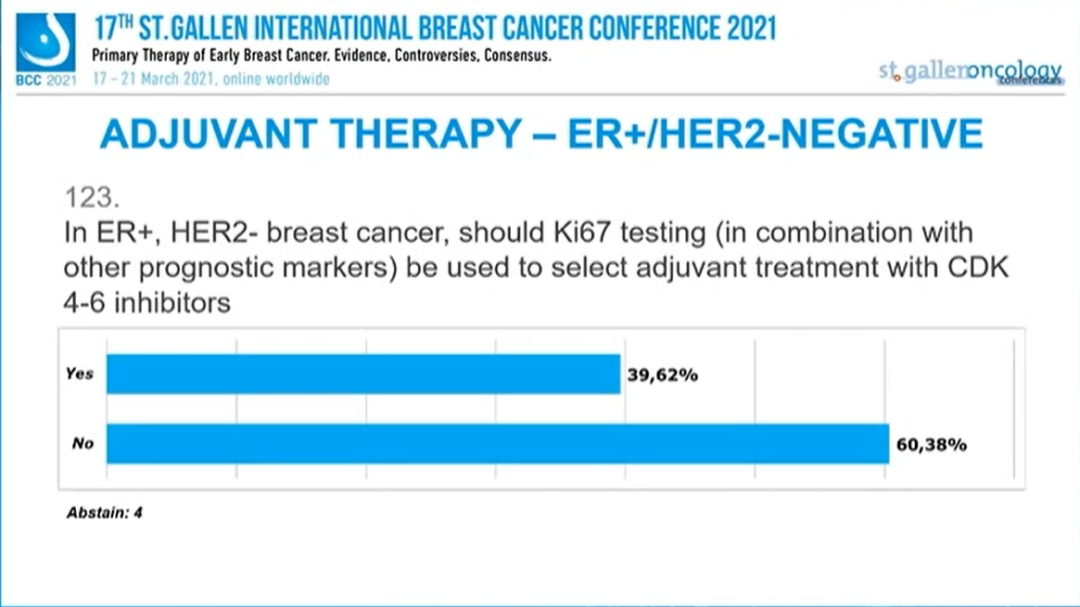
对于ER+/HER2-的乳腺癌患者,辅助治疗中Ki67检测(联合其他预后标志物)是否应该被用来指导CDK4/6抑制剂的选择?
39.62%的专家选择“是”,60.38%的专家选择“否”,4人弃权。
临床表现符合MINDACT、TAlILORx、RxPonder和类似试验的低风险和/或复发评分≤25的绝经后患者,是否应该接受化疗?
20.75%的专家选择“是”,79.25%的专家选择“否”,4人弃权。

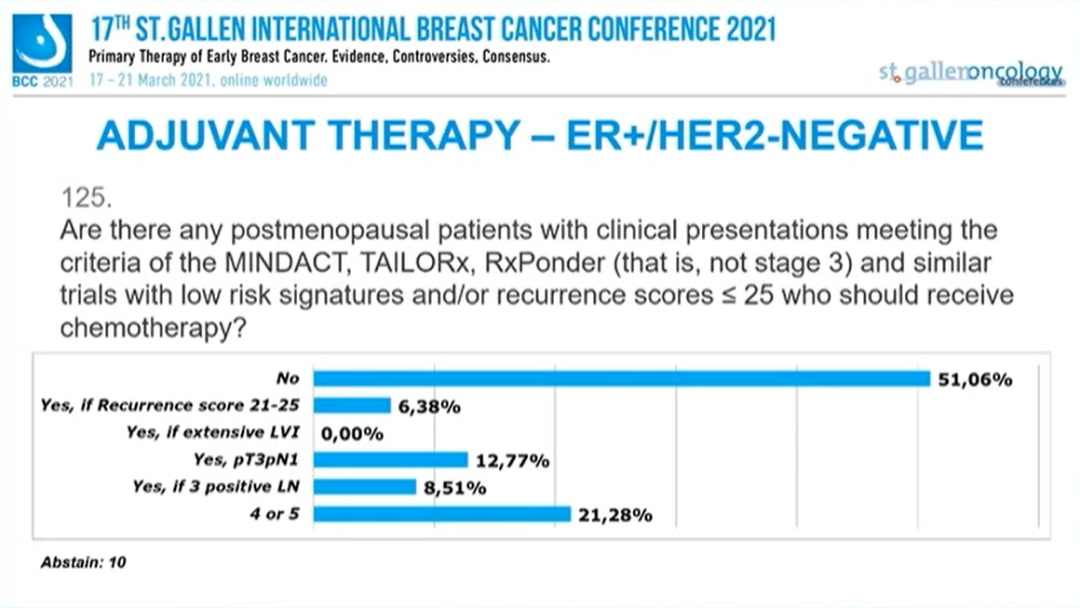
临床表现符合MINDACT、TAlILORx、RxPonder(即不是3期)以及类似试验的低风险和/或RS≤25的绝经后患者,是否应该接受化疗?
51.06%的专家选择“否”,6.38%的专家选择“是,如果患者复发评分为21-25”,12.77%的专家选择“是,如果患者pT3pN1”,8.51%的专家选择“是,如果患者3个淋巴结阳性”,21.28%的专家选择“4-5个淋巴结阳性”,10人弃权。
临床分期为2期的ER+绝经后乳腺癌患者,应该接受卵巢抑制吗?
70.59%的专家选择“是”,29.41%的专家选择“否”,4人弃权。

年龄<40岁,临床分期为2期的ER+绝经后乳腺癌患者,应该接受卵巢抑制吗?
94.34%的专家选择“是”,5.66%的专家选择“否”,4人弃权。

化疗诱导的卵巢抑制对化疗有效性的可能贡献(与ER+早期乳腺癌的绝经前女性化疗的“细胞毒性”效应相反,具有良好的生物学特征,如ER/PR/grade/Ki67或较低风险的基因组特征)估计:
4.65%的专家选择“没影响”,13.95%的专家选择“小于35%”,25.58%的专家选择“大约50%”,41.86%的专家选择“至少75%”,13.95%的专家选择“100%”,14人弃权。

哪些临床分期为2期的绝经前ER+女性应该接受卵巢抑制?(如果给予,假设化疗后持续处于绝经前激素状态)
42.59%的专家选择“所有患者”,1.85%的专家选择“仅T3或N1”,3.70%的专家选择“仅中/高风险”,51.85%的患者选择“如果高风险(年龄<40岁,N+,高KI67和/或luminal B/中或高基因组特征)”,3人弃权。

有足够风险进行化疗的绝经前ER+/HER2-乳腺癌患者,如果化疗后仍处于绝经前,也应接受卵巢抑制?
94.34%的专家选择“是”,5.66%的专家选择“否”,3人弃权。

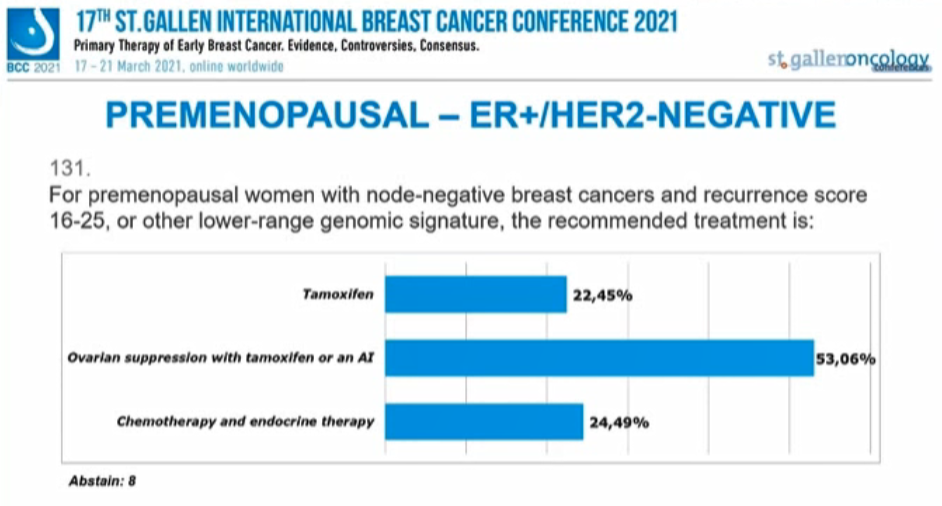
淋巴结阴性、RS 16-25或基因风险低的绝经前患者,推荐的治疗方案是?
22.45%的专家选择“他莫昔芬”,53.06%选择“OFS+TAM或AI”,24.49%选择“化疗+内分泌治疗”,另有8人弃权。
对于1-3枚LNs阳性且RS≤25或其他基因风险低的绝经前患者,推荐治疗方案是?
30.19%的专家选择“化疗和口服内分泌治疗”,16.98%选择“OFS和口服内分泌治疗”,26.42%选择“任何方案都行,但倾向于化疗”,26.42%选择“任何方案都行,但倾向于内分泌治疗”,4人弃权。

1期或2期、淋巴结阴性的ER+患者的首选辅助治疗方案是?
32%的专家选择“TC×4”,选择“TC×6”和“AC/EC×4”的比例分别为12%和14%,选择“剂量密集AC/EC×4→T×4”和“AC/EC×3→T×3”的比例分别为6.0%和2.0%,超过三分之一(34%)的专家认为“任何以蒽环/环磷酰胺/紫杉为基础的标准方案均可”。

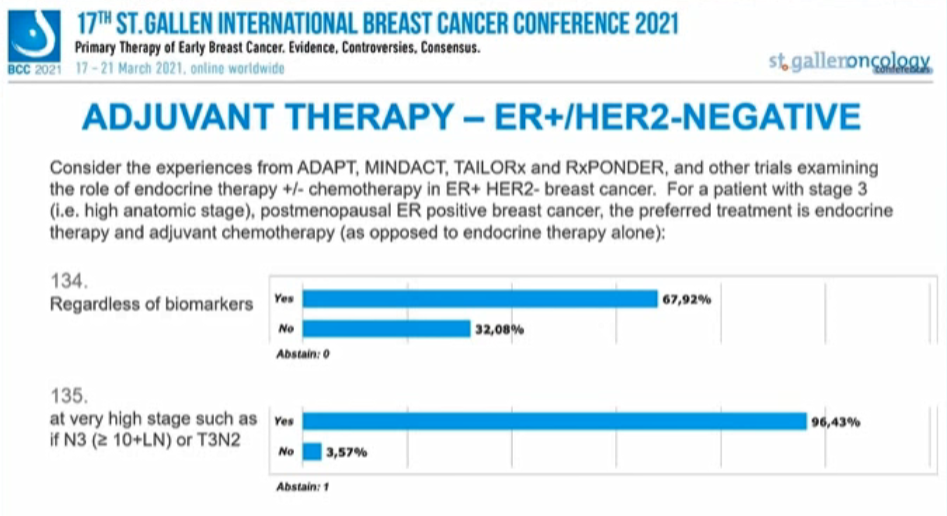
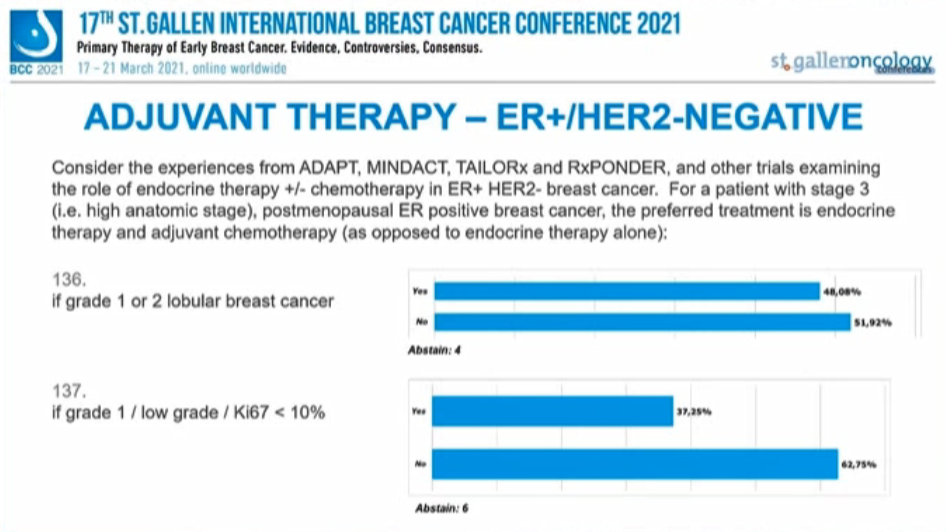
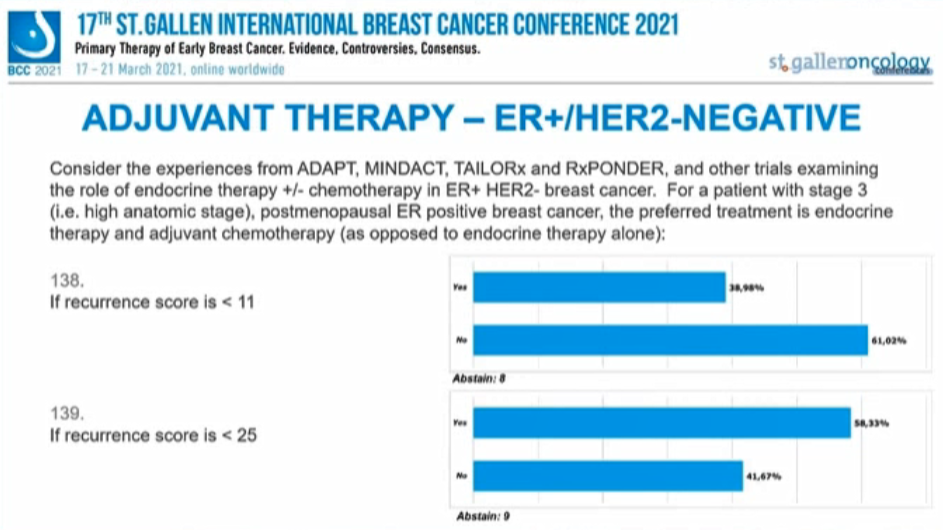
考虑来自ADAPT、MINDACT、TAILORx和RxPONDER以及其他ER+/HER2-乳腺癌内分治疗研究的经验,对于3期(如解剖学分期高)绝经后ER阳性患者的首选辅助治疗是内分泌联合化疗(与单独内分泌治疗相反):
67.92%的专家支持“无论任何生物标志物”均应首选内分泌+化疗,支持“分期非常高的,如N3(≥10枚淋巴结阳性)或T3N2”的比例为96.43%,仅半数专家(48.06%)支持“G1或2的小叶癌”,多数专家(62.75%)不支持“G1/低级别/Ki-67<10%”。
近三分之二的专家(61.02%)认为“RS<11”可以避免化疗,58.33%的专家认为“RS<25”需要联合化疗。
肿瘤分期或肿瘤负荷较高(如3期)的ER阳性患者,其适合的辅助化疗方案是?
超过一半的专家(57.14%)认为“任何以蒽环/环磷酰胺/紫杉为基础的标准方案均可”,超过三分之一的专家(38.78%)选择“剂量密集AC/EC×4→T×4”,另分别有2.04%的专家选择“TC×4”和“AC/EC×4”。

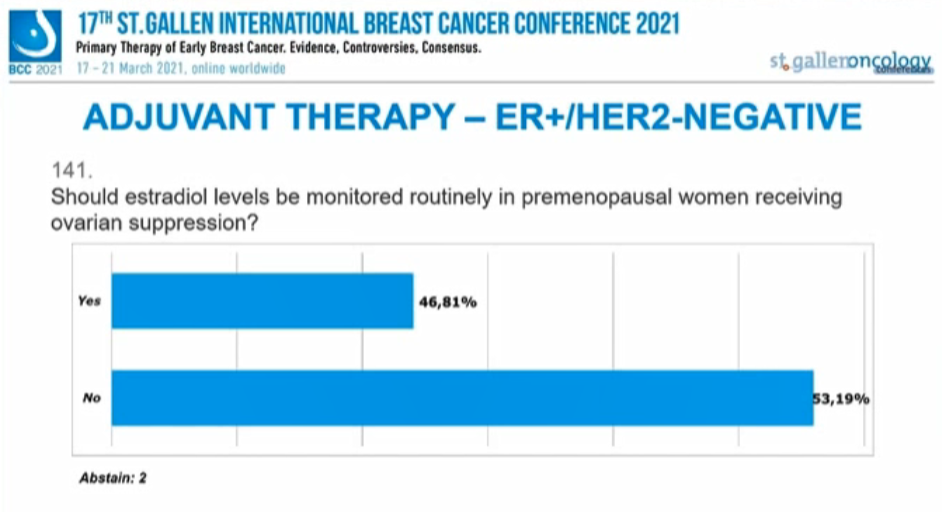
绝经前患者接受卵巢功能抑制是否应常规监测雌激素水平?
46.81%的专家选择“是”,53.19%的专家选择“否”。
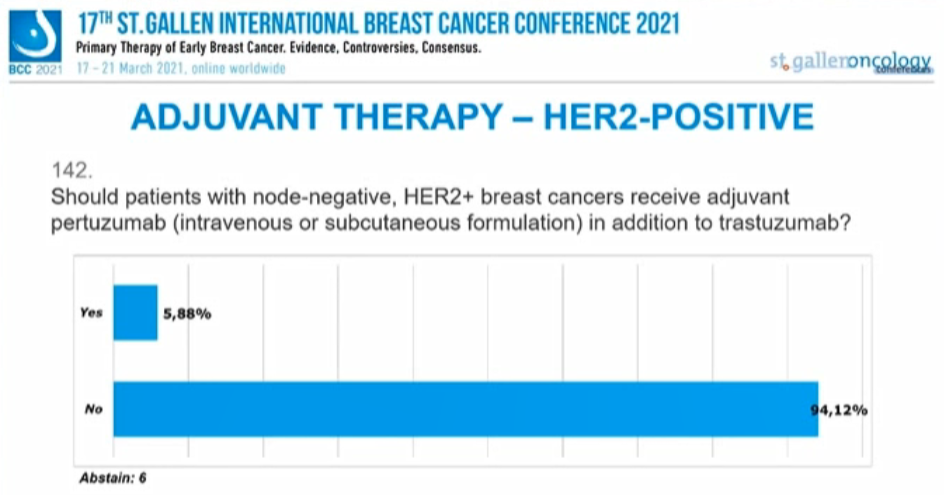
淋巴结阴性的HER2+乳腺癌患者是否需要在曲妥珠单抗基础上联合帕妥珠单抗(静脉内或皮下注射)?
94.12%的专家选择“否”,5.88%的专家选择“是”,另有6人弃权。
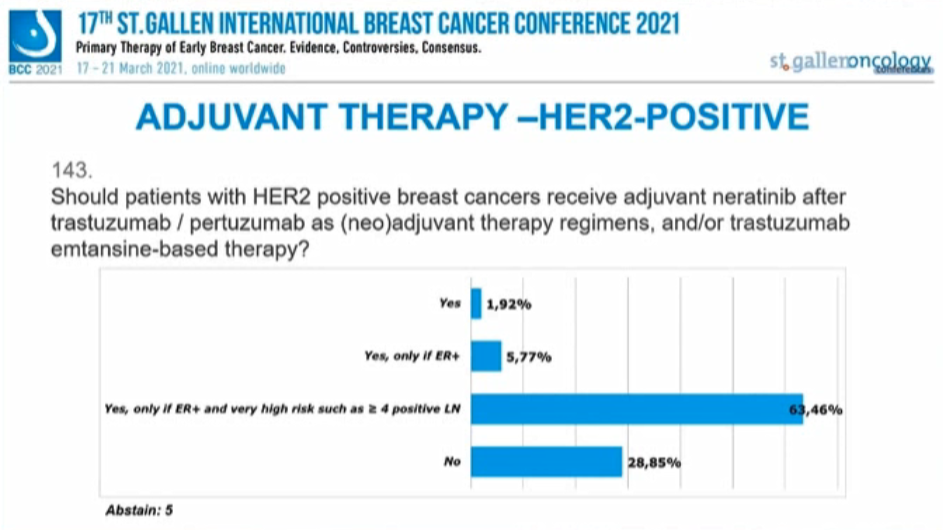
HER2+患者在曲妥珠单抗/帕妥珠单抗(新)辅助治疗,和/或T-DM1治疗后,是否应该接受奈拉替尼辅助治疗?
63.46%的专家认为“仅在ER+且非常高危(LN≥4枚阳性)”需要,28.85%的患者认为不需要,5.77%的患者认为“ER+”患者需要,没有考虑任何因素而支持奈拉替尼序贯治疗的专家比例为1.92%。
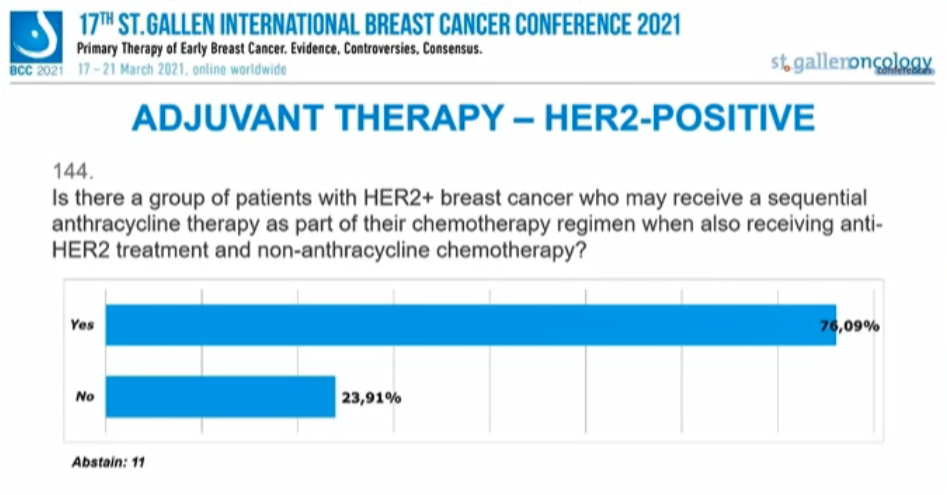
是否有一组HER2+乳腺癌患者在抗HER2治疗和非蒽环类化疗的同时,可能接受蒽环类序贯疗法作为化疗方案的一部分?
76.09%的专家选择“是”,23.91%的专家选择“否”,另有11人弃权。
1期的HER2+患者辅助治疗,T-DM1能否替代紫杉醇/曲妥珠单抗?
没有专家持完全肯定意见,超过三分之二的专家(68.52%)持否定意见,另有近三分之一的专家(31.48%)认为“仅在特定情况下可以”。

未经新辅助治疗的2期或3期TNBC患者,其辅助治疗是否需要在化疗基础上联合PD-1/PD-L1免疫检查点抑制剂?
仅有不足一成的专家(9.62%)选择“是”,90.38%的专家选择“否”,另有5人弃权。

基于奥拉帕利对晚期BRCA1/2相关乳腺癌的耐受性,如果OlympiA研究显示以下哪些数据你会推荐奥拉帕利用于BRCA1/2相关早期乳腺癌的辅助治疗?
7.69%的专家选择“仅在OS获益的情况下”,25.00%的专家选择“3年iDFS率绝对获益>10%”,48.08%选择“3年iDFS率绝对获益>5%”,19.23%选择“3年iDFS率绝对获益>2%”。






 京公网安备 11010502033352号
京公网安备 11010502033352号