在以人群为基础的队列研究中,原发性皮肤黑色素瘤中有58%~81%的患者为薄黑色素瘤(定义为T1期,即Breslow厚度≤1cm)。由于紫外线照射的增加,人口老龄化,以及早期诊断意识的提高等,世界范围内薄黑色素瘤患者的数量正在稳步增加。总体来说,这些患者的预后较好,其5年生存率为88.6%~98.8%。但还会有一部分患者出现疾病复发。由于薄黑素瘤患者在所有确诊的黑素瘤患者中占如此高的比例,从绝对数量来看,最终死于T1期黑素瘤的患者比死于T2、T3或T4期的人数更多。因此,预测T1期患者的预后也尤为重要。
到目前为止,还没有基于人群的关于薄黑色素瘤患者复发的研究,目前的文献报道的这些患者的生存率也不一致,不确定哪些因素是最终结果的重要预测因素。在四项已发表最大的研究中,两项研究结果显示溃疡的存在是显著预测因素;但在另外两项研究中,一项研究中没有体现,另外一项研究中没有考虑。
本研究的目的是利用现有的临床病理信息,开发并验证列线图(Nomogram图)预测薄黑色素瘤患者的局部、区域和远处复发风险。
该列线图开发模型的资料来源于荷兰病理学注册机构PALGA收集的2000年1月至2014年12月间荷兰新诊断的浸润性皮肤黑色素瘤患者的数据,这些数据前瞻性地收集了荷兰所有病理实验室的结果,并被编码匿名使用。
对于验证模型,研究者澳大利亚黑色素瘤研究所(MIA)前瞻性维护的数据库中搜索了同一时期在该研究所最初诊断和治疗的薄黑色素瘤患者。排除黑色素瘤复发后转诊到MIA的患者,以消除转诊偏倚。所有患者都已同意将他们的数据记录在MIA数据库中并用于研究目的。
纳入标准为Breslow厚度≤1.0 mm的黑色素瘤患者。初步临床诊断为Ⅲ或Ⅳ期疾病的患者,年龄<18岁以及患有多发性原发性黑色素瘤的患者均被排除在外。每个患者收集的信息包括诊断日期,诊断年龄,性别,Breslow厚度(以mm为单位,四舍五入到小数点后一位)溃疡(有或无),T-分期(根据第八版美国癌症联合委员会[AJCC]分期手册的定义结合了Breslow厚度和溃疡情况),黑色素瘤亚型(浅表播散型黑色素瘤、结节型黑色素瘤、雀斑性黑色素瘤、肢端雀斑型黑色素瘤),原发肿瘤的解剖部位(头颈部、躯干、上肢或下肢),核分裂(存在或不存在),前哨淋巴结(SN)活检状态(阳性、阴性或未进行),复发(日期、部位和类型[局部、区域淋巴结或远处])。
无复发生存率(RFS)计算从黑色素瘤初次诊断日期到复发诊断日期。结果包括局部RFS(LRFS)、区域RFS(包括转移,RRFS)和远处RFS(DRFS)。研究的结果并不相互排斥,例如,经历局部复发和后来出现局部复发的患者在不同的时间导致了LRFS和RRFS,会被审查为DRFS。无复发的患者在其死亡日期、已知最后存活日期或2018年1月1日(数据库截止日期)进行审查,以发生时间较早的日期为准。
分类变量按照频率被展现(百分比),连续变量总结为中位数(范围)。为了比较MIA队列和荷兰队列,变量采用卡方检验或Mann-Whitney U检验进行分析。采用LRFS、RRFS和DRFS作为结果,进行单变量和多变量Cox比例风险回归分析来估计风险比和95%CI。对于每个结果,对初始模型进行了向后变量选择程序,包括变量年龄、性别、部位和病理报告中现成的参数(Breslow厚度、溃疡状态、分期、黑色素瘤亚型和SN状态)。
从多变量模型中得到列线图来预测每个结果。通过计算曲线下面积来评估模型的预测能力,反映模型识别复发患者的程度。每个列线图的10年预测能力通过开发和验证队列的时间依赖性ROC曲线进行评估。为了纠正过度乐观,通过bootstrapping算法进行内部验证。外部验证也通过将开发队列的系数和基线危险值应用于验证队列进行。为了校正数据,用列线图风险评分法将患者分为三组。低危组包括患者风险评分分布最低的5%,高危组为前5%,中危组为剩余患者。
共检索到25930例荷兰患者和2968例MIA患者的数据,其基线特征见表1。对1143例荷兰患者(4.4%)和284例MIA患者(9.6%)进行了SN活检。荷兰队列的中位随访时间为6.7年(95%CI:6.6~6.7),MIA队列的中位随访时间为12.0年(95%CI:11.7~12.3)。Breslow厚度<0.8 mm的黑素瘤患者与厚度为0.8~1.0 mm的黑素瘤患者的RFS差异有统计学意义。这一发现在两组队列间是一致的,具有相同的统计学显著性差异(P<0.0001)。荷兰和MIA患者在每个Breslow厚度分类中的RFS曲线几乎相同。
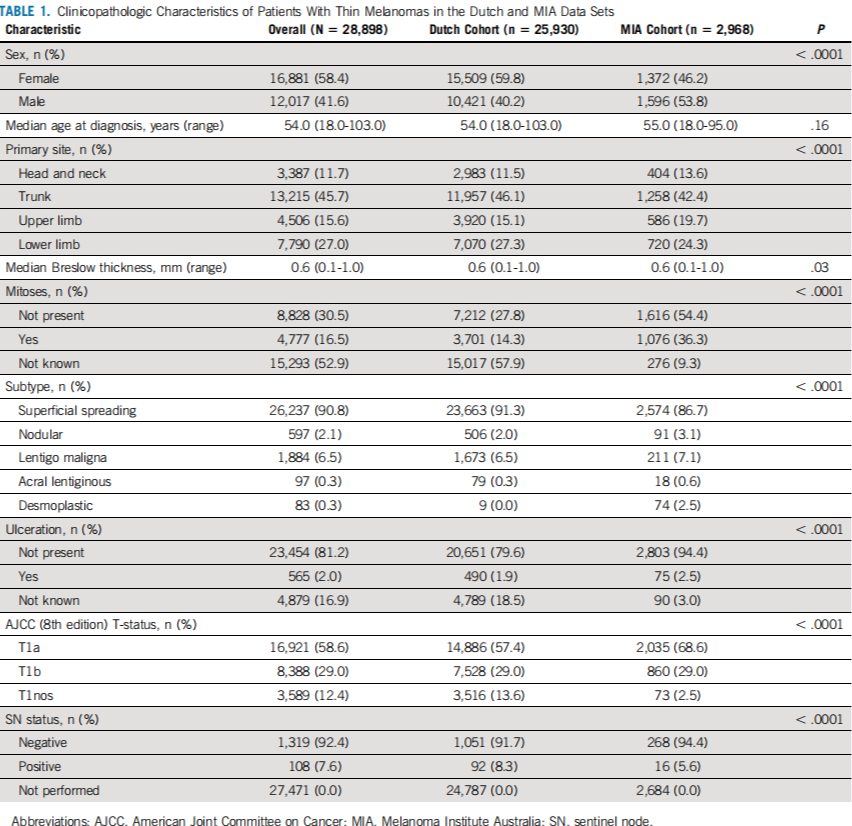
表1.荷兰和MIA数据集中薄黑色素瘤患者的临床病理特征
在807例(3.1%)出现复发的荷兰队列患者中,出现局部、区域和远处复发的患者分别为209例(0.8%)、503例(1.9%)和203例(0.8%)。在124例(4.2%)出现复发的MIA队列中,出现局部、区域和远处复发的患者分别为23例(0.8%),61例(2.1%)和75例(2.5%)。表2为开发队列的LRFS,RRFS和DRFS的单变量和多变量Cox回归分析结果。偏差测试的结果不支持每个生存结果与Breslow厚度和年龄之间的非线性关系。

表2.荷兰发展队列中薄黑色素瘤患者LRFS,RRFS和DRFS的单变量和多变量竞争风险COX回归分析
开发队列的LRFS,RRFS和DRFS的C统计值分别为0.79(95%CI:0.75~0.82),0.77(95%CI:0.75~0.78)和0.80(95%CI:0.77~0.83)(图1)。使用 bootstrapping算法进行内部调整后,分别为0.79(95%CI:0.75~0.79),0.77(95%CI:0.75~0.79)和0.80(95%CI:0.77~0.83),这表示没有过度拟合。使用MIA队列对LRFS,RRFS和DRFS进行外部验证,C统计值分别为0.80(95%CI:0.69~0.90),0.76(95%CI:0.70~0.82)和0.74(95%CI:0.69~0.80),确认了列线图对LRFS,RRFS和DRFS的低、高风险患者具有较高的鉴别能力。
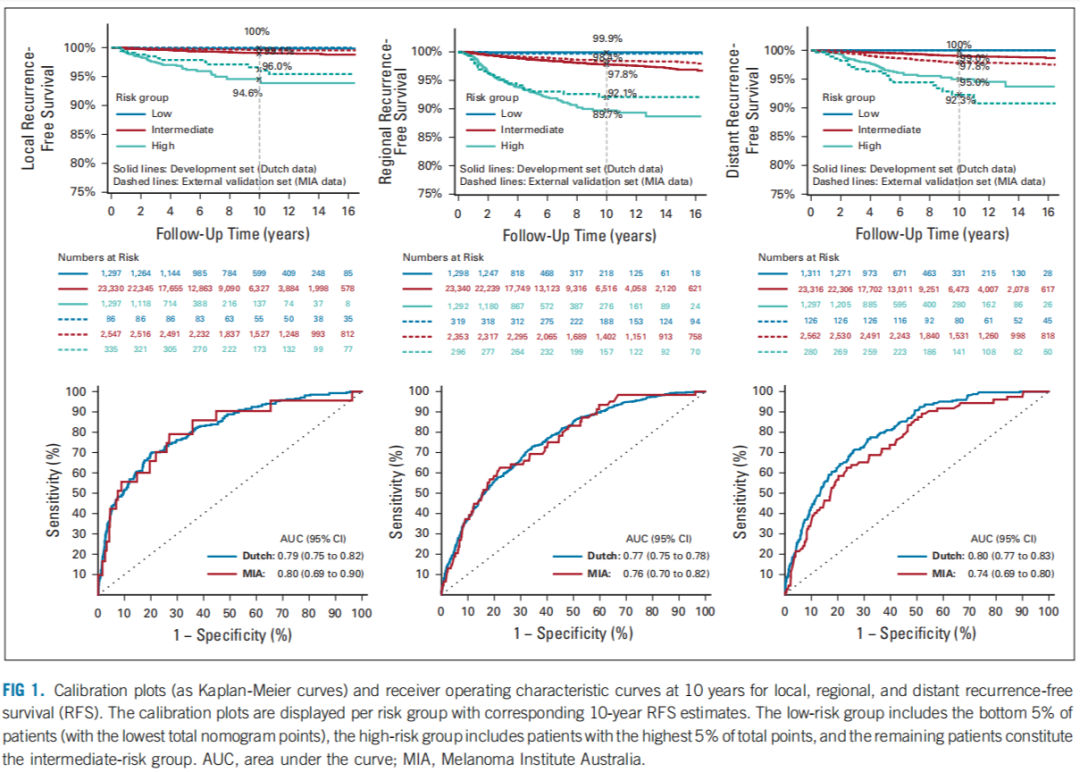
图1.局部、区域和远处无复发生存率(RFS)的10年校正图(Kaplan-Meier曲线)和受试者操作特征曲线。校准图按风险组显示,并附有相应的10年RFS估计值。低危组包括最低5%的患者(列线图总分最低),高危组包括最高5%的患者,其余患者构成中危组。AUC,曲线下面积;MIA,澳大利亚黑色素瘤研究所。
开发队列C统计值结合第8版AJCC的T分期和SN状态(包括T1nos患者)的得出的LRFS,RRFS和DRFS分别为0.67(95%CI:0.63~0.70),0.68(95%CI:0.66~0.70)和0.70(95%CI:0.66~0.73);外部验证队列分别为0.65(95%CI:0.54~0.76),0.66(95%CI:0.59~0.73)和0.65(95%CI:0.59~0.71)。开发模型和拟列线图之间C统计值的增加都具有统计学意义(P<0.0001),在开发队列中为9%到12%,在验证队列中为11%到15%。(图2A-C)

图2.列线图预测薄黑色素瘤患者LRFS(A),RRFS(B),DRFS(C)。
图1显示了列线图校正后的情况和低危、中危和高危组的Kaplan-Meier曲线,这是根据LRFS、RRFS和DRFS列线图中风险评分的前5%和后5%的患者分布情况得出的。校正后的列线图显示,荷兰和MIA数据之间所有危险组的生存曲线很一致。使用列线图风险评分的5%为临界值,在开发队列中,低危组的10年LRFS率为99.8%(95%CI:99.6~100),而高危组为94.6%(95%CI:92.7~96.5)。在验证队列中,低危组的10年LRFS率为100%(95%CI:100~100),而高危组为96.0%(95% CI:93.7~98.4)(图1)。使用列线图风险评分的10%为临界值时,也可以看到类似的结果。
补充数据显示,在低危组和中危组中,开发和验证队列中LRFS、RRFS和DRFS的观察和预测的10年RFS概率非常相似。补充数据还显示了LRFS、RRFS和DRFS的开发和验证集的风险评分直方图,分别使用最低和最高排名的5%和10%的患者。在补充数据中,对每个列线图以5%为节点划分为高危组T1a患者复发进行了概述。所有患者均为黑素瘤,厚度为0.7 mm,无溃疡形成(即T1a)。
基线危险函数曲线清楚地表明,薄黑素瘤患者最常见的是区域复发,其次是远处复发和局部复发。随着时间的推移,局部复发的基线危险函数相当稳定,而远处和区域性复发的曲线则相当稳定。复发明显是非线性的,在黑色素瘤诊断后的前3年风险增加。
与直觉相反的事实是,T1期原发肿瘤患者是大多数黑色素瘤死亡的罪魁祸首,现在有充分的证据证明这一点。然而这些患者的疾病复发很少受到关注,以前没有发表过基于人群的研究报道。先前的研究仅报道了在学术机构和专门的黑色素瘤治疗中心管理患者的数据,目前AJCC分期系统也仅考虑了T分期和SN状态来预测T1期黑色素瘤患者的生存期。
在先前的研究中,我们发现由于黑色素瘤而死亡的相当一部分薄黑色素瘤患者的分期相对较晚,只有29%的死亡发生在确诊后5年内。目前的结果显示,两个队列的复发率之间存在很小的差异:荷兰队列为3.1%,澳大利亚队列为4.2%。复发率的差异可能归因于多个因素,包括MIA队列的中位随访时间较长(12.0年vs. 6.7年),以及两个队列之间的性别分布存在差异(在MIA队列中53.8%为男性vs. 荷兰队列中40.2%为男性),因为男性和女性可能会有不同的寻求健康行为。
黑色素瘤分期的最新变化已导致指南建议改变,对于可能伴有较高淋巴结累及风险的T1黑色素瘤患者(例如,T1b,有溃疡或相对较高的Breslow厚度),应考虑进行SN活检。目前的列线图能够识别T1a患者,这些患者通常不推荐SN活检,但对于局部、区域或远处复发的高风险患者,可能受益于该手术。
当前研究的优势包括样本量大,以及发展模式使用了整个国家的基于人口的数据。这导致了未选择的研究人群,并增加研究结果的普遍性。另一个优点是建立的模型在一个独立队列中得到验证,使其成为薄黑素瘤患者第一个验证的RFS模型。使用常规临床实践中收集的病理数据表明,该模型是有用的。此外,大多数以前的研究包括较少的数据元素,缺乏重要的预后标准,如溃疡。
与我们研究的回顾性性质不可避免地相关局限性是一些缺失的数据,以及我们只能包括经组织病理学检查证实的黑色素瘤复发患者的事实。虽然在大多数患者中,可以获得疑似疾病复发的组织病理学证实,但可能有一些患者仅通过影像学评估复发。这可能导致低估这些T1期患者的复发次数。相反,由于我们没有将死亡视为竞争风险,因此可能会稍微高估患者复发的机会。
另一个局限性在于,国际指南中的T1黑色素瘤患者SN活检标准尚不明确,只是建议考虑该程序。这可能导致两个队列临床医生决定是否对患者进行SN活检。但是,由于大多数T1期黑色素瘤患者Breslow厚度<0.8 mm,无溃疡或其他不良预后因素,因此,无论遵循哪种指南,大多数患者均不符合SN活检的条件。
在荷兰队列中较短的中位随访也是一个局限性(6.7年 vs. 12.0年),因为一些晚期复发的患者可能被忽略了。最后一个限制是,预后因素中未纳入淋巴管浸润和切除切缘状态等因素,因为在荷兰数据集中未充分记录这些因素。
总之,考虑到有大量的黑色素瘤患者存在,此项研究开发的列线图为更充分的分期、更好的SN活检选择和基于风险的黑色素瘤患者管理提供了合理的基础。研究者还将协助规划适当的随访时间表,并确定临床试验的资格和分层。为了便于在临床实践中实施,已经开发了可以在智能手机,平板电脑或计算机上随时访问的在线计算器,并且可以免费在线使用。
El Sharouni, Mary-Ann et al. “Development and Validation of Nomograms to Predict Local, Regional, and Distant Recurrence in Patients With Thin (T1) Melanomas.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology, JCO2002446. 18 Feb. 2021, doi:10.1200/JCO.20.02446 




 京公网安备 11010502033352号
京公网安备 11010502033352号