多年来,众多的医学专家和基础学科的专家一直致力于肿瘤的分类和精准治疗,乳腺癌是其中进展比较快的瘤种。2005年St. Gallen会议专家共识提出采用ER,PR,HER-2和Ki-67四个标志物的免疫组化结果来进行乳腺癌的分类,以便评估预后和预测疗效,指导个体化治疗。通过十余年的广泛临床应用,这种分类方法取得了巨大的成功,但是也遇到了一些问题,例如:ER(+)HER-2(-)这一类Lumimal分型的患者总体复发风险不高,但是是否应该化疗难以抉择,尤其是对于临床分期较早的患者。各类指南对此也语焉不详,常常采用±符号来让医生决定[1]。
为了更好的解决这个问题,多基因检测登上历史舞台。多基因检测就是采用多个与乳腺癌复发风险高低有关的基因检测结果评估复发风险以指导是否接受化疗的方法。从2002年到2011年,总共有超过9种多基因检测方法问世,分别是 21基因检测;70基因检测;PAM50; EndoPredict;Breast cancer Index (BCI 乳腺癌指数);BluePrint;IHC4;Mammostrat;NPI plus和Randox Breast Cancer Array[2]]。
下表列出了几种数据相对比较充分的多基因检测方法及其适用人群[3]。
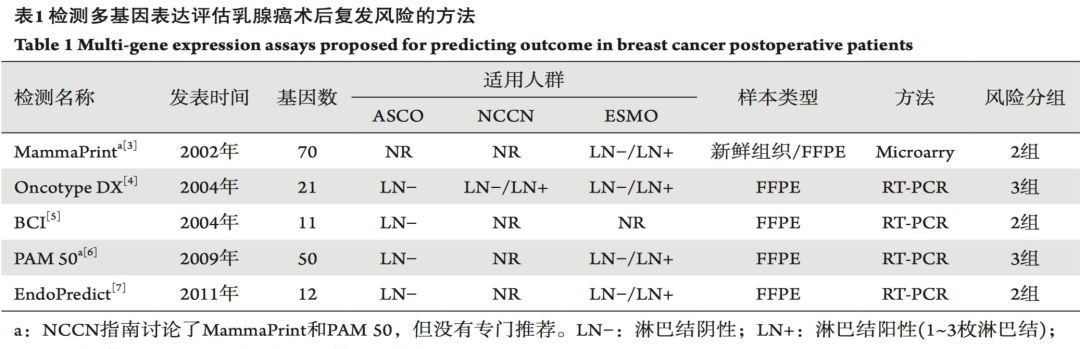
多基因检测方法的主要临床应用价值在两个方面:预后评估和化疗决策,下面对几个临床证据相对充分的检测方法做一简单评述。
2.1 Oncotype DX 21基因检测
乳腺癌21基因检测是针对ER阳性、HER-2阴性、淋巴结阴性的早期乳腺癌患者,采用PCR法定量检测肿瘤组织中21个特异性基因的表达水平,进而给出一个复发评分(recurrence score,RS)来评估肿瘤患者的复发风险。根据RS值可分为高、中、低3组,其10年远期复发率分别为30.5%(高),14.3%(中)及 6.8%(低)。根据复发风险不同而给出不同的辅助治疗建议。例如高风险组患者建议接受化疗,低风险组仅接受内分泌治疗而避免化疗,中风险组根据具体情况决定其治疗方式。该方法验证人群超过10万人,得到较为广泛的临床专家认可,并于2008年获得美国NCCN乳腺癌治疗指南的推荐。
2.2MammaPrint(70 基因)
MammaPrint是由荷兰癌症研究院于2002年开发的用于淋巴结阴性的乳腺癌患者术后预后的多基因检测系统,其后扩展到1到3枚淋巴结阳性的患者。该检测系统检测与复发转移风险相关的70个基因,根据基因表达情况分为两个档次,高复发风险组(10年复发风险49.4%)及低复发风险组 (10年复发风险14.8%)。 2007年,FDA批准MammaPrint可以在美国用于检测所有年龄的淋巴结阴性的乳腺癌患者,而不用考虑ER状态。目前,参与MammaPrint检测临床试验的患者人数超过1.2万名。
2.3 PAM50
PAM50在设计之初用于乳腺癌分型[6],后发展用于复发风险评估分层。PAM50根据50个基因的表达谱计算得出复发得分 (PAM50 ROR) ,同21基因检测一样把复发风险分为低、中、高3组。2013年发表在JCO的研究表明:与21基因检测相比,两者术后5年复发风险预测能力基本相同。因此,PAM50在2013年获得FDA批准。
2.4 EndoPredict
EndoPredict(EP)也是针对于ER阳性、HER2阴性乳腺癌患者的复发风险预测模型,该检测系统检测11个与复发转移相关基因的表达水平,计算风险得分(EP), 然后结合患者的肿瘤大小和淋巴结状况得到综合的风险得分(EPclin)。与MammaPrint70基因检测一样,根据风险分为两档,高、低风险两组[7]。EndoPredict的优势在于预测内分泌治疗后5年及10年长期预后方面,一些研究表明其预测能力要优于21基因检测。EP预后效能的前瞻性随机试验正在进行,作为临床试验 UNIRAD(NCT01805271)的一部分,其预测化疗疗效的能力也有待验证。目前,EP的诊断试剂盒已在欧洲上市,尽管该检测尚未被NCCN指南推荐[3]。
国内外的各大乳腺癌相关指南对多基因检测都有关注,但多数并未获得较高级别的推荐。2017年St. Gallen早期乳腺癌专家共识中对多基因检测(Oncotype DX,MammaPrint,PAM50, EndoPredict, BCI)在临床中的应用进行了投票,结果显示多数专家对Oncotype DX 21基因检测最为推荐,支持在淋巴结阴性ER+HER-2阴性患者中应用21基因检测进行预后预测并考虑是否豁免化疗的专家比例达到了93.8%,在淋巴结阳性患者中支持比例60%,远高于支持其他多基因检测方法的比例。NCCN乳腺癌治疗指南2018V3版也仅对21基因检测进行了推荐。因此,下文中我们对21基因检测进行更为详细的分析。
2004年Paik等[4]为通过多基因检测预测ER+ LN-乳腺癌患者的复发风险,根据文献和基因库筛选出250个复发相关候选基因,采用已经得到明确预后数据的NSABP B-20研究中组织蜡块标本进行RT-PCR检测,通过该研究患者预后筛选出与远处复发相关的21个基因,包括了16个肿瘤相关基因(包括增殖、侵袭、HER-2,ER)和5个内参基因。通过复杂的公式计算出复发评分(recurrence score,RS),其数值范围在0-100之间,分为三组:<18为低危,18-31为中危,≥31为高危组。具体基因及计算方法如图1。
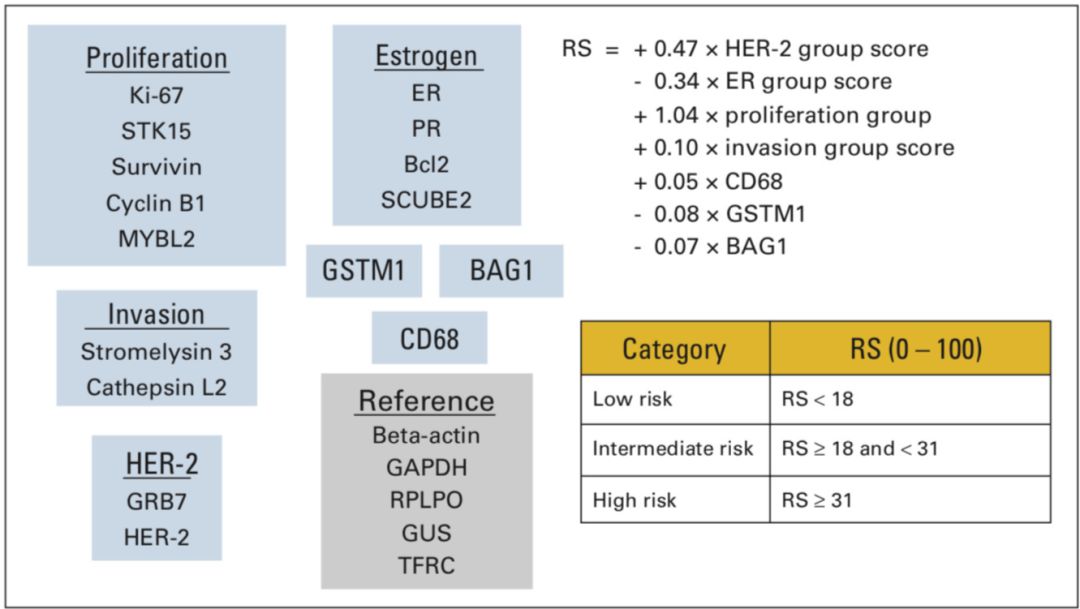 图1 21基因检测中采用的基因名称和RS计算公式
图1 21基因检测中采用的基因名称和RS计算公式
随后,采用该检测方法在另外一个研究NSABP B-14试验中的人群进行了验证。高、中、低危组的10年复发风险分别为30.5%,14.3%和6.8%,很好的验证了该检测方法在预后预测方面的价值。见图2。
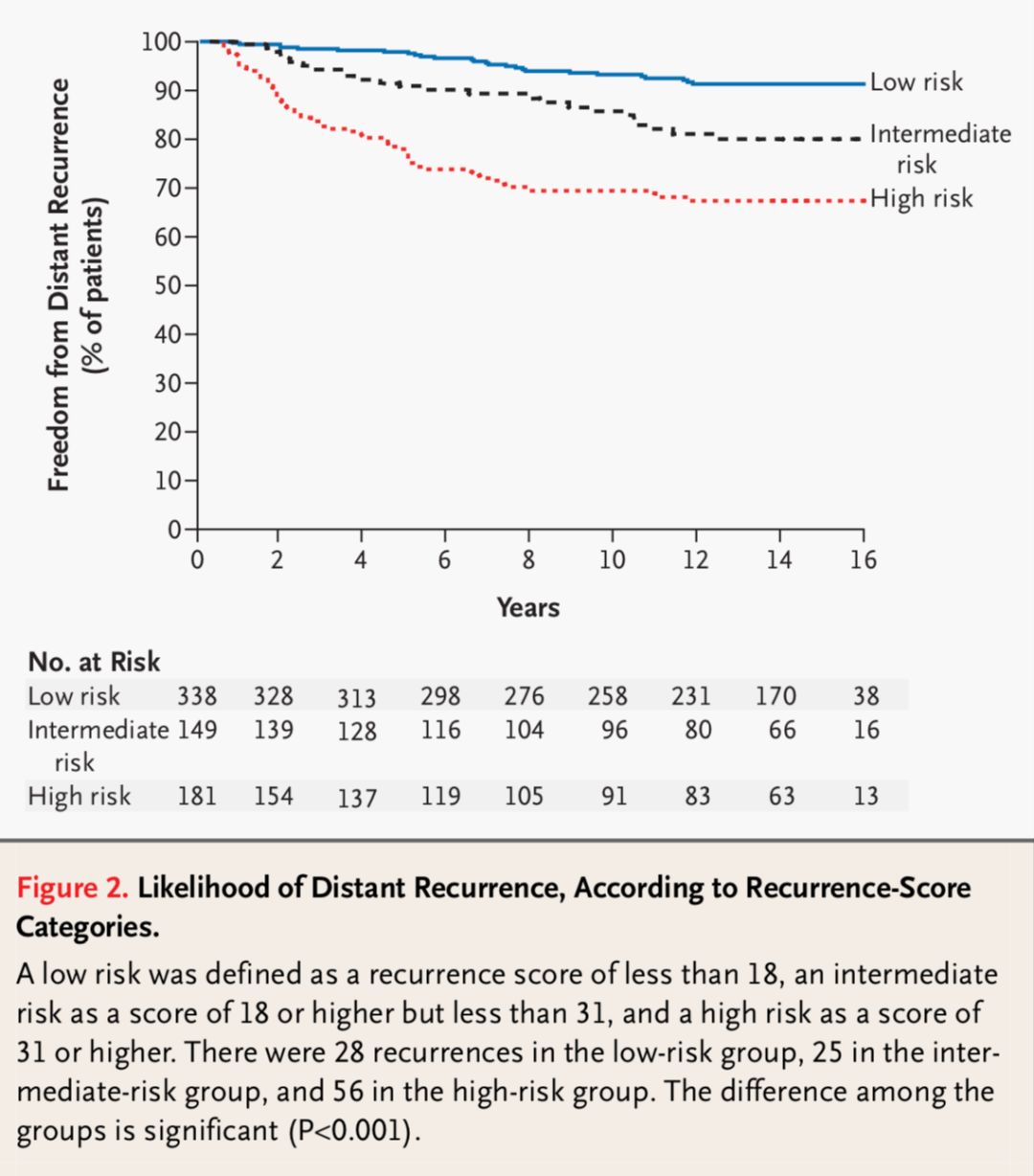 图2 根据不同RS评分组的远处复发生存曲线
图2 根据不同RS评分组的远处复发生存曲线
低复发风险被定义为RS评分小于18,中复发风险为18-31,高复发风险为大于31。低中高各组的复发病例数分别为28,25和56。组间有显著性差异(P<0.001)
3.2 21基因检测的回顾性验证
随后的10余年中,多个国家的众多研究小组针对21基因检测进行了大量的验证研究,包括在美国国家癌症数据库(143,032例)[5],SEER数据库(241681例)[6],NSABP B28研究人群等大规模人群中的验证结果表明:21基因检测在ER+ HER-2阴性 淋巴结阴性乳腺癌患者中有非常良好的预后预测作用,18和31两个界值设定合理。尤其是SEER数据库超过24万例患者人群的验证研究中,21基因检测成功预测了乳腺癌特异性死亡风险。有一些研究者开始将21基因检测应用于淋巴结阳性(NSABP B28,SWOG)甚至晚期乳腺癌患者(TBCRC 013)的预后分析研究中。虽然有了如此大量的验证性数据支持Oncotye DX 21基因检测,但这些研究都是证据级别不高的回顾性数据分析,因此需要更高级别的前瞻性随机对照研究进一步证明21基因检测方法的有效性。同时,还有一个问题需要解决,RS分值介于中危的患者是否应该选择化疗,这也需要前瞻随机对照研究来明确。
3.3 21基因检测的前瞻性研究
21基因检测有两个重量级的前瞻性研究结果已经发布,分别是美国的TAILORx研究和德国的PlanB研究。限于篇幅,我们仅介绍更为重要的前者。
TAILORx研究由Sparano教授发起,2006年4月7日至2010年10月6日研究最终入组10253名患者。该研究是一项大规模前瞻性随机对照研究。研究设计中,根据RS分值采用全新的11和25两个界值将试验人群分为:≤10的低危组(A组 仅内分泌治疗);≥26的高危组(D组 化疗+内分泌);11-25分随机分为B组(仅内分泌治疗)和C组(化疗+内分泌治疗)[7]。这里还需要说明一点,研究者为什么将原来的界值18和31更换为了11和25,可以从研究者于2008年发表在JCO杂志上的一篇对TAILORx研究设计进行说明的文献中初窥端倪[8]。在进行前瞻性研究设计时,研究者为了更好的规避使那些原本应该接受化疗的患者被错误的分在低危组而没有接受化疗,采用了95%可信区间对不同RS值10年远处复发生存曲线重新进行了分析,选择了11和25两个新的界值。见图3。
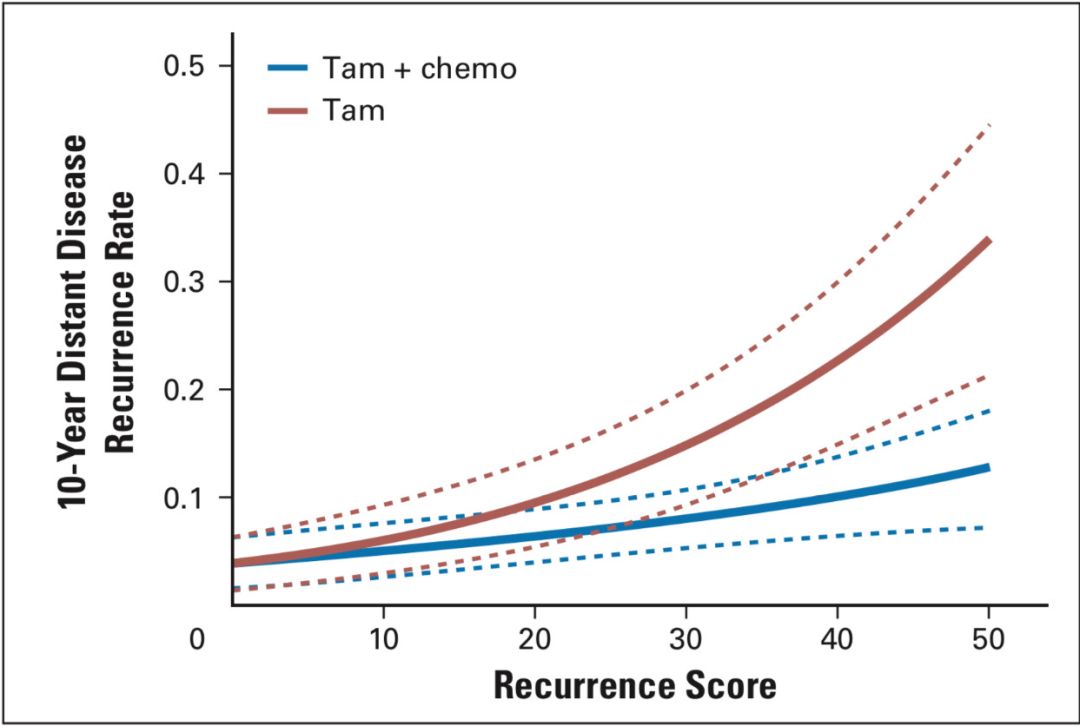 图3 RS界值的重新界定
图3 RS界值的重新界定
TAILORx研究结果在2018年ASCO大会作为重磅研究发布,并同期发表于NEJM杂志。研究结果表明:RS分值在11和25之间的患者,不论是iDFS还是DRFI,单纯内分泌治疗的B组都不劣于内分泌联合化疗的C组(HR1.08,p=0.26;HR1.03,p=0.80)。见图4。通过亚组分析,最后作者审慎的推荐:对于激素受体阳性,HER-2阴性,淋巴结阴性的早期乳腺癌患者满足以下条件,可以省去化疗:
1)年龄>50岁, 风险评分在0-25分,这类患者在这一年龄组中大约占85%;
2)年龄≤50岁, 风险评分在0-15分之间,这类患者在这一年龄组中大约占40%。
上述人群占总的乳腺癌人群的15.7%。
该研究结果不仅证实21基因检测在之前确定的低危和高危人群中的预测和指导治疗作用,还进一步确定多数中危人群也可以免去化疗。
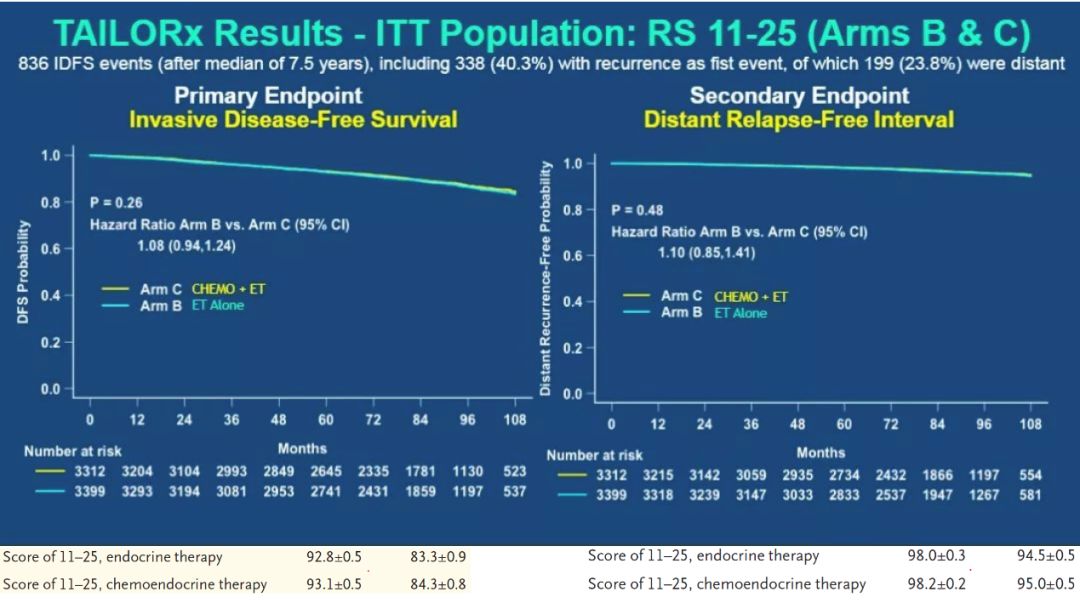 图4 TAILORx研究主要终点iDFS和次要终点DRFI分析
图4 TAILORx研究主要终点iDFS和次要终点DRFI分析
结语:综上所述,多基因检测方法是传统根据免疫组化对乳腺癌进行分类方法的有益补充,目前已有多种模型在研并取得一定的成功。21基因检测是其中的佼佼者之一,大量的回顾性验证以及有限的前瞻性研究证实其可以对激素受体阳性,HER-2阴性,淋巴结阴性/阳性的乳腺癌患者进一步进行危险度分层并据此进行预后判断和指导临床治疗策略。当然,目前的多基因检测方法仍然存在前瞻性研究数据不足,缺乏不同人种数据等缺点,使其临床应用受限。相信随着更多的临床研究结果的公布,多基因检测必将成为乳腺癌临床医生的有用工具。

王 廷
第四军医大学西京医院甲乳血管外科
副教授,副主任医师,医学博士,硕士研究生导师
中国医药教育协会乳腺癌专业委员会常委
北京乳腺病防治学会肿瘤免疫治疗专业委员会常委
陕西省生物医学工程学会理事
陕西医师协会乳腺甲状腺专科医师分会总干事
陕西省抗癌协会乳腺癌专业委员会常委
陕西省保健协会甲状腺疾病专业委员会副主委
全军普通外科学专业委员会乳腺学组 委员





 京公网安备 11010502033352号
京公网安备 11010502033352号